Livtencity (maribavir)
Livtencity®▼ (maribavir) er den første godkjente behandlingen for cytomegalovirus (CMV)-infeksjon og/eller -sykdom som er refraktær (med eller uten resistens) mot en eller flere tidligere behandlinger, inkludert ganciklovir, valganciklovir, cidofovir eller forskarnet hos voksne pasienter som har gjennomgått hematopoetisk stamcelletransplantasjon (HSCT) eller organtransplantasjon (SOT). 1 1. Livtencity preparatomtale godkjent 7/2023, kap 4.1, kap 4.2. Hentet fra https://www.ema.europa.eu/no/documents/product-information/livtencity-epar-product-information_no.pdf
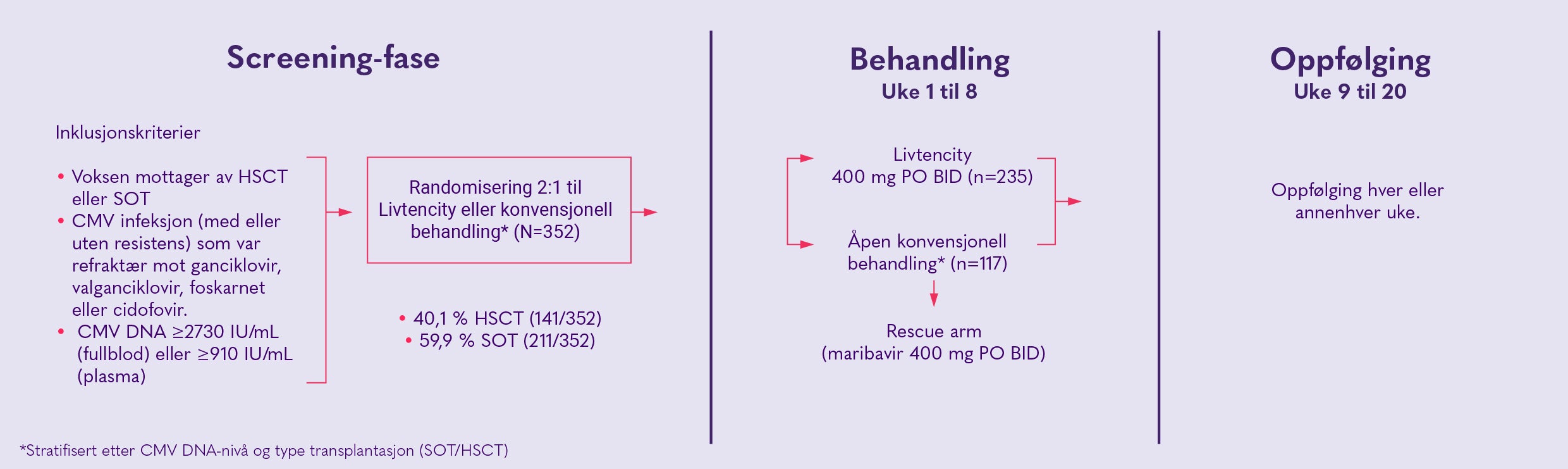
SOLSTICE-STUDIEN
SOLSTICE-studien var en multisenter, randomisert, åpen, aktiv kontrollert studie, som undersøkte effekt og sikkerhet av Livtencity sammenlignet med konvensjonell behandling* hos stamcelle- eller organtransplanterte med CMV-infeksjon (med eller uten resistens) som var refraktær mot ganciklovir, valganciklovir, foskarnet eller cidofovir. 2 2. Avery RK, et al. Maribavir for Refractory Cytomegalovirus Infections With or Without Resistance Post-Transplant: Results From a Phase 3 Randomized Clinical Trial. Clin Infect Dis. 2022;75(4):690-701

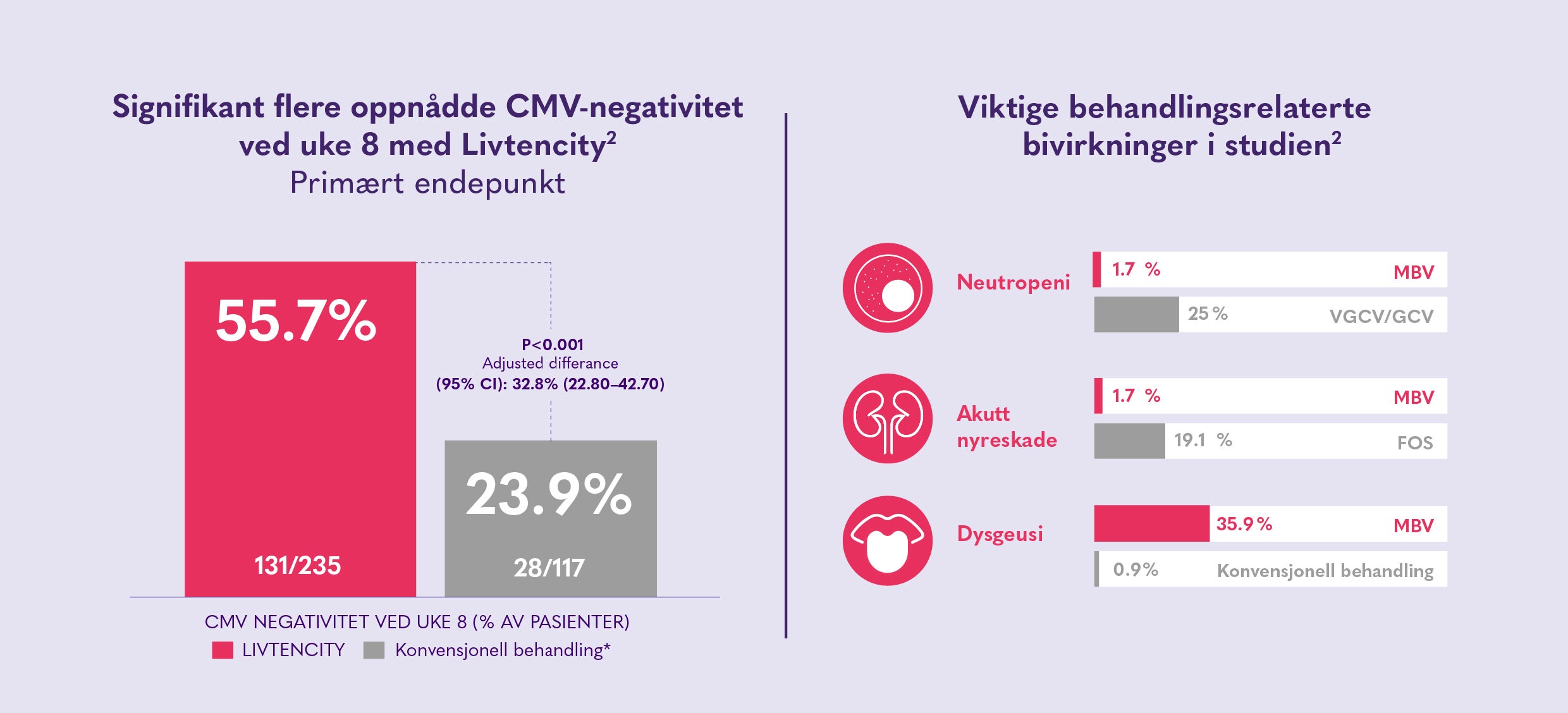
EFFEKT OG SIKKERHET 2 2. Avery RK, et al. Maribavir for Refractory Cytomegalovirus Infections With or Without Resistance Post-Transplant: Results From a Phase 3 Randomized Clinical Trial. Clin Infect Dis. 2022;75(4):690-701
* mono- eller kombinasjonsbehandling (≤2 legemidler) med intravenøs (IV) ganciklovir, oral valganciklovir, iV foskarnet eller IV cidofovir.
Det bør tas hensyn til offisielle retningslinjer for riktig bruk av antivirale midler. Livtencity skal ikke brukes samtidig med ganciklovir eller valganciklovir. De vanligste rapporterte bivirkningene var smaksforstyrrelser, kvalme, diaré, oppkast og fatigue.
DOSERING 1 1. Livtencity preparatomtale godkjent 7/2023, kap 4.1, kap 4.2. Hentet fra https://www.ema.europa.eu/no/documents/product-information/livtencity-epar-product-information_no.pdf



